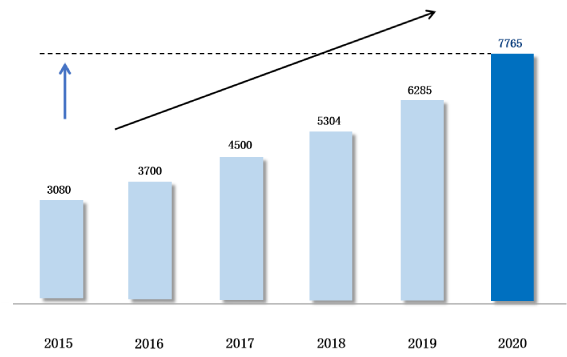
X 2.5
倍2015 年醫療器械
市場容量
1.023 Million
家醫療機構
35,000
家醫院
9.11 Million beds
醫療機構床位數
注:以上地圖因篇幅所限,可能無法顯示極小區域。
完整版地圖請以中華人民共和國中央人民政府官方網站為準
(http://www.gov.cn/guoqing/2017-07/28/content_5043915.htm )
中國政府主動進一步開放醫療器械市場
在海南自由貿易港和粵港澳大灣區試點實施優惠政策,進一步開放市場,加快引入先進醫療器械,加速醫療器械產業轉型。
NMPA 中國藥監局官方網站,以了解最新醫療器械政策和政府動態
粵港澳大灣區
優惠政策
全國同步的醫療器械市場準入機制
對于已在香港或澳門上市的具有CE或FDA認證,但未取得NMPA證書的醫療器械,大灣區定點醫療機構可在獲得廣東省政府批準后,采購香港和澳門公立醫院正在使用中臨床急需進口和具有先進臨床技術的醫療器械。
真實世界數據政策
對于臨床急需進口的醫療器械,可使用真實世界數據進行內地NMPA注冊。
海南自由貿易港
優惠政策
真實世界數據策略 [- 進 口醫療器械 - ]
與大灣區政策類似,對于臨床急需的進口醫療器械,可以使用真實世界數據進行NMPA注冊。
關稅和稅收政策 [ - 合資國產醫療器械 - ]
鼓勵類產業企業生產的商品通過“二線”進入中國大陸,對商品免征進口關稅并享受征稅優惠政策(即海南自由貿易港到其他地區)。
Start Business in CHINA
Various investment support from Fosun Pharma are available to help manufacturers adjust their business strategy with flexibility
投資 中國
獨資企業

咨詢 服務
美中互利提供
合資企業

財務支持

人力資源

土地資源
美中互利 & 復星醫藥提供
很遺憾,除非制造商在中國設有具有資質的分支機構來處理注冊問題,否則這是不合法的且不合規的,進而,海外制造商必須指定中國代理人進行醫療器械注冊。
對于NMPA注冊費,進口醫療器械第二類醫療器械注冊費為21.09萬元,第三類醫療器械注冊費為30.88萬元。此外,還應考慮其他可能的費用,例如文件翻譯費、臨床試驗費等。
注冊材料經國家藥監局受理后,第二類醫療器械技術審評需要60個工作日,第三類醫療器械技術審評需要90個工作日。國家藥監局要求補充材料的,生產企業有義務在一年內提交,否則可能終止評審。
有 CE 或 FDA 證書的醫療器械可以在沒有 NMPA 注冊證的情況下進入特別行政區。對于大灣區和海南省作為試點地區,在香港或澳門已上市的醫療器械,經當地政府批準,試點地區定點醫療機構愿意采購臨床急需醫療器械的,可進入試點地區。
京ICP備11010059號-1  京公網安備11010502035116號 (京)網藥械信息備字(2023)第 00034 號 版權所有©美中互利(北京)國際貿易有限公司
京公網安備11010502035116號 (京)網藥械信息備字(2023)第 00034 號 版權所有©美中互利(北京)國際貿易有限公司
京公網安備11010502035116號